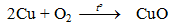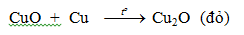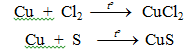Trong cuộc sống, Đồng là 1 nguyên tố vô cùng rất gần gũi và quan trọng, chúng góp hầu như cho đời sống xã hội. Vị vậy hôm nay thailantour.com xin giữ hộ đến chúng ta 1 số kiến thức và kỹ năng về Đồng qua nội dung bài viết về đặc thù vật lí, nhận biết, tính chất hóa học tập của đồng, điều chế và ứng dụng.
Bạn đang xem: Cu trong hóa học là gì
Các tính chất hóa chất hóa học của Đồng(Cu) không thiếu nhất

Định nghĩa của Đồng
Đồng tiếng Anh là Copper, là nguyên tố hóa học trong bảng tuần trả nguyên tố có ký hiệu là Cu, có số hiệu nguyên tử bởi 29. Đồng là sắt kẽm kim loại dẻo gồm độ dẫn điện với dẫn nhiệt độ cao. Đồng nguyên chất mềm và dễ uốn; mặt phẳng đồng tươi bao gồm màu cam đỏ. Nó được thực hiện làm chất dẫn nhiệt cùng điện, vật liệu xây dựng, cùng thành phần của các hợp kim của không ít kim một số loại khác nhau.
+ thông số kỹ thuật electron: 1s22s22p63s23p63d104s1 hay
+ Số hiệu nguyên tử: 29
+ trọng lượng nguyên tử: 64 g/mol
+ vị trí trong bảng tuần hoàn: Ô: số 29; nhóm: IB; Chu kì: 4
+ Đồng vị: 63Cu, 64Cu, 65Cu.
Xem thêm: Lời Bài Hát Gia Tu - Lời Bài Hát Giã Từ (Lyrics)
+ Độ âm điện: 1,9
Tính chất vật lí:
– Là sắt kẽm kim loại màu đỏ, dẻo, dễ dàng kéo sợi cùng tráng mỏng.
– Dẫn điện và nhiệt không nhỏ (chỉ kém hơn bạc). D = 8,98g/cm3; t0nc= 1083oC
Nhận biết
– Đơn hóa học đồng gồm màu đỏ, các hợp chất của đồng sinh hoạt trạng thái dung dịch có màu xanh da trời khá sệt trưng.
– tổ hợp Cu vào dung dịch HNO3 loãng, thấy thu được dung dịch có greed color lam, bay ra khí không màu hóa nâu trong không gian (NO). CT: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Tính hóa học hóa học
Là sắt kẽm kim loại kém hoạt động, gồm tính khử yếu, công dụng với phi kim, tác dụng với axit, tính năng với hỗn hợp muối
Tác dụng với axit:- Cu không công dụng với hỗn hợp HCl, H2SO4 loãng.- Khi có mặt oxi, Cu tác dụng với dung dịch HCl, khu vực tiếp xúc giữa hỗn hợp axit với không khí.2Cu + 4HCl + O2 → 2CuCl2 + 2 H2O- với HNO3, H2SO4 đặc :Cu + 2H2SO4 đ → CuSO4 + SO2 + H2OCu + 4HNO3 đ → Cu(NO3)2 + 2NO2 + 2H2O3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2OTác dụng với dung dịch muối:
– Khử được ion sắt kẽm kim loại đứng sau nó trong dung dịch muối.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Cu → Cu2+ + 2eTác dụng cùng với phi kim:- Đồng (Cu) phản ứng với oxi khi đun nóng sản xuất CuO bảo đảm an toàn nên Cu không bị oxi hoá tiếp tục.